ASPECTOS GENERALES DEL FUNCIONAMIENTO DE LOS CONTADORES HEMATOLÓGICOS AUTOMÁTICOS.
Actualmente se dispone de una gran gama de equipos en el laboratorio de hematología, como los auto analizadores, los cuales requieren una muestra pequeña con un mínimo de entre 20-50 µ preferentemente de sangre total anticoagulada con EDTA.
Por otro lado, se aconseja que los tubos de las muestras estén cerrados para que haya una menor manipulación.
RECOMENDACIONES PREVIAS AL INICIO DEL ANÁLISIS.
Antes de analizar la muestra hay que verificar aspectos como:
· Hay que comprobar los desechos biológico, y en el caso de que haya, vaciarlos.
· Comprobar el estado de los reactivos, preparando las cantidades suficientes.
· Limpiar las máquinas en el caso de que no tengan autolavado, comprobando la limpieza con el test en blanco.
· Coger una muestra conocida y del día anterior, conservada en la nevera, y procesarla comprobando los resultados.
· Emplear los preparados para el control interno.
Otro de los aspectos de suma importancia es la idoneidad de la muestra, teniendo en cuenta la cantidad y si el tubo es el correcto.
Cada equipo cuenta con un programa informático para el control de la calidad y donde el fabricante plasmará las características del producto.
La calibración consistirá en corregir las desviaciones comparando las cifras de referencia con las aportadas por el equipo.
Lo más importante a tener en cuenta respecto a los resultados es su exactitud y reproducibilidad. Los valores aceptables variarán en función del dispositivo empleado, pero aquellos en los que se supera un coeficiente de variación superior al 5%, no sería aceptable y hay que suspenderlos.
Además de comprobar la exactitud comparando los resultados con los de referencia, es importante también comprobar la repetitividad de los resultados mediante un control preparado por el propio laboratorio, procesándolo varias veces a lo largo de las jornadas.
- Proceso de validación de la técnica.
La automatización ha permitido asumir grandes cargas de trabajo y a conseguir resultados de calidad en periodos de tiempos más breves, pero queda incertidumbre principalmente en los resultados patológicos, de que algún dato no sea real, por lo que hay análisis que es necesario revisarlos.
En la actualidad se dispone de unos sistemas expertos que permite validar de forma automática la mayoría de los resultados emitidos por los analizadores, y es el operario que manipula la maquina el que se encarga de validar la técnica.
RECUENTO DIFERENCIAL DE LEUCOCITOS.
La aparición de los instrumentos que interpretaban frotis sanguíneos se remonta a los años 70, siguiendo los criterios de microscopia óptica, pero fueron considerados equipos ineficientes, ya que no era proporcional los costos que suponían con las prestaciones que ofrecían.
Hoy día el Diff o fórmula leucocitaria (recuento diferencial o leucocitario) es realizado hoy día prácticamente por todos los analizadores.
En este recuento se puede suministrar 3 (Granulocitos, monocitos y linfocitos) o 5 poblaciones (neutrófilos, basófilos, eosinófilos, linfocitos y monocitos), además de información morfológica adicional.
Los resultados del diferencial proporcionado son de alta calidad, mirando hasta 200 el observador manual, y llegando a 8.000 los equipos con tecnología VCS.
En la actualidad el resto de parámetros hematológicos son suministrados por los equipos que ofrecen RDL automático, facilitando este la realización de los análisis y abaratando los costes.
Technicon fue el primero en desarrollar el primer equipo capaz de realizar un RDL, este equipo fue el Hemalog D, el cual realizaba el diferencial de 5 poblaciones, analizando el volumen celular y la medición de propiedades citoquímicas de los leucocitos.
Años más tarde esta misma casa, con le H-6.000, unió el diferencial leucocitario con el recuento de las tres series celulares.
Debido a las grandes dimensiones del Hemalog, se eliminaron todas la tinciones menos la peroxidasa (utilizada en neutrófilos y eosinófilos), y se empleaba el análisis de lobularidad con luz láser para identificar los basófilos, que esta además identificaba la presencia de neutrófilos en cayado; desarrollándose un parámetro denominado Índice de Lobularidad (IL).
En estos equipos, por lo tanto, se mezclarán los métodos ópticos y los citoquimicos (peroxidasa) para el diferencial leucocitario, y la luz láser para el recuento de eritrocitos y plaquetas.
Los equipos más actualizados de Technicon son los ADVIA, y son distribuidos por Siemens.
Los herederos de estos métodos de impedancia son en la actualidad la principal empresa suministradora de analizadores hematológicos.
Los equipos Coulter, se encargan de la serie roja y trombocítica y del diferencial leucocitario de 5 poblaciones con tecnología VSC, siendo los modelos más actuales los de la línea LH.
Concretamente el LH 780 posee un software de calidad que da a los usuarios flexibilidad y mide la desviación de la amplitud de la población de eritrocitos para estudios como la anemia. El nuevo paquete de control de calidad XM proporciona el peso exponencial (EWMA) del recuento celular completo (CBC), el diferencial de 5 partes, recuento de eritrocitos nucleados (NRBC) y de reticulocitos.
Aunque los dos mencionados anteriormente son los más comunes en el mercado actual, también existen otros como:
· Sysmex: el primero fue fabricado en 1963 con el nombre de CC-1001 y consistía en un contador de glóbulos rojos. Estos equipos poseen un método único, el método de radiofrecuencia, que consiste en comprobar la capacidad que tiene el leucocito de emitir ondas de radio, pudiéndose diferenciar así las distintas poblaciones y el volumen. La citometría de flujo con láser semiconductor es utilizada para analizar las células blancas. En estos sistemas una dispersión a doble ángulo nos va a proporcionar dos tipos de información de los leucocitos:
§ Impulsos de dispersión en ángulo bajo informan sobre el tamaño celular.
§ Impulsos de dispersión en ángulo alto informan sobre la complejidad interna de la célula.
Para la detección y cuantificación de gránulos inmaduros en los glóbulos blancos para la determinación de una patología se utilizarán los equipos Sysmex de la serie X, y todo ello gracias a la tecnología de citometría de flujo fluorescente y al software que poseen. Con una tinción con tinte fluorescente Polimetina B, del ADN podremos comprobar el grado de madurez de los linfocitos.
· HORIBA-ABX: serie de analizadores que mezclan la citoquímica (tinción con negro sudán) y el diferencial con impedancia. Su aportación tecnológica es el doble enfoque hidrodinámico, con el que se puede obtener un análisis muy detallado del diferencial leucocitario. Lo más actualizado que ha sacado la casa es el recuento diferencial leucocitario (RDL) automatizado con tinción de las células de naranja de tiazol combinado con lectura con luz láser a 0º y 90º y esto junto con la medición de resistividad permite obtener un RDL de 5 poblaciones, eritrocitos, granulocitos inmaduros, linfocitos atípicos y blastos. También puede leer muestras de médula ósea.
· ABBOTT CELL DYN: son equipos de larga trayectoria y el más avanzado en la actualidad es el CELL DYN Sapphire , que combina dispersión de luz óptica e impedancia, incluyendo la separación mediante difusión luminosa polarizada en diferentes ángulos, permitiendo el recuento de células sanguíneas y diferencial 5 partes con fluorescencia a tres colores. Para la detección de eritroblastosis se utilizará la citometría de flujo con detección en múltiples ángulos de dispersión de la luz. El único contador hematológico q puede procesar de manera automática los anticuerpos mononucleares es el Cell Dyn, permitiendo esto hacer un recuento en el laboratorio de los CD61 en 4 minutos y de CD3/4 y CD3/8 inmuno T.Cell (subpoblaciones linfocitarias) en 7 minutos.
EL RECUENTO DE RETICULOCITOS.
“Podemos definir a los reticulocitos como eritrocitos inmaduros que contienen en su citoplasma restos del ARN procedentes del núcleo celular ya destruido, que, en contacto conciertos colorantes precipita en forma de forma de filamentos o gránulos visibles al microscopio óptico”(11). Constituye el paso intermedio entre el eritroblasto y el eritrocito y su número en la sangre periférica es de suma importancia para la determinación de posibles patologías.
MÉTODO MANUAL DE RECUENTO DE RETICULOCITOS.
Existen varias formas de hacer un examen microbiológico de las células hemáticas, siendo la más común la tinción con Azul Cresil Brillante o azul de metileno.
Para realizar el examen es necesario sangre total anticoagulada con EDTA y una solución de azul de metileno al 1% en solución salina fisiológica añadiendo 0.4 gramos de citrato trisódico. Está recomendado emplear una parte significativa de la muestra de la sangre total y del colorante que se unirán en un tubo de hemodiálisis agitándose la mezcla suavemente e incubándose a 37ºC durante 15 minutos; con esto se prepararán tres frotis y se dejan secar. A continuación se llevará a cabo el recuento una vez realizada la tinción.
Se colocará el objetivo a 100x y se busca una zona donde aparezcan unos 200 hematíes aproximadamente, identificando los reticulocitos existentes en dicha zona. Se deberán observar 2.000 eritrocitos (10 zonas aproximadamente de las comentadas anteriormente) y anotar el número de reticulocitos detectados.los reticulocitos vistos en proporción de los hematíes en porcentaje son en el varón sano 0.5-2.8% y en la mujer 0.2-2.5%. para corregir la muestra se emplea la siguiente fórmula:
Reticulocitos corregidos (%) = reticulocitos observados (%) x Hto paciente/Hto normal
MÉTODOS AUTOMÁTICOS DE RECUENTO DE RETICULOCITOS
La citometría de flujo con la tinción es la manera más usual de contar los reticulocitos de forma automática, haciendo que se detecten las células al ser enfrentadas a la luz láser.
La medición se realizará empleando colorantes (fluorocromos): naranja de tiazol en el Technicon o azul de metileno en Horiba-ABX, entre otros colorantes.
Estos sistemas nos permite comprobar la intensidad de la fluorescencia de los reticulocitos, siendo los más jóvenes los que más fluorescencia tenga, ya que posee más ARN, siendo este dato de gran importancia ya que el grado de maduración de los reticulocitos ayudará en el estudio de la eritropoyesis.
ALGUNOS EJEMPLOS DE CONTADORES AUTOMÁTICOS DE RETICULOCITOS.
· ADVIA 120: mide simultáneamente los índices eritrocitarios y reticulocitarios. Los cuantificaciones que se obtienen son: el volumen reticulocitario (MCVr), la concentración corpuscular media de hemoglobina reticulocitaria (CHCMr) y el contenido de hemoglobina de los retículos (CHr). Unos valores de CHr<26 pg. indica que no se dispone de forma adecuada y normal de hierro para la eritropoyesis. También se mide la madurez del eritrocito viendo la capacidad para absorber que tiene (ya que estos pueden ser de alta, media o baja absorción), y si tiene más cantidad de ARN indica inmadurez.
· SYSMEX: estándar en recuento y determinación de reticulocitos. Emplea diodos de láser de Argón y citometría de flujo.
· COULTER: para el recuento de reticulocitos, utiliza 0,200 ml de azul de metileno precalentado para añadirle 0,031 ml de sangre total e incubarlo a 37ºC, para colorear el ARN y los ribosomas del reticulocito, separando aquello reticulocitos que nos ofrezca información fiable mediante la tecnología VCS (volumen, conductividad y dispersión de la luz láser).
AUTOMATIZACIÓN EN EL LABORATORIO: RECUENTOS CELULARES, VELOCIDAD DE SEDIMENTACIÓN GLOBULAR. PRUEBAS DE HEMOSTASIA.
Actualmente, en los laboratorios de rutina existen unas dinámicas de trabajo en las cuales, para realizar la mayoría de las técnicas la forma manual de trabajo ha sido reemplazada por el trabajo de las maquinas.
RECUENTO DE CÉLULAS SANGUÍNEAS.
Se puede definir como recuento de células sanguíneas, como la medida de la concentración de estas células circulantes en la sangre, junto a la concentración de hemoglobina (HB) y los índices eritrocitarios. Todos estos datos, constituyen el hemograma.
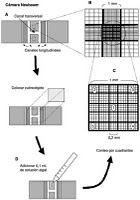
La técnica de recuento de células hemáticas ha experimentado un proceso de evolución a lo largo del tiempo, que la ha llevado de ser primordialmente manual (mediados de los sesenta) a ser una técnica realizada por maquinas. Para realizar el recuento manualmente se emplea una cámara cuenta glóbulos, la más habitual es la llamada cámara de Neubauer.
RECUENTO HEMATOLÓGICO MANUAL
Para realizar el recuento hematológico manual se precisan una serie de elementos:
- Sangre sanguínea venosa o arterial.
- Líquidos de dilución.
- Pipetas calibradas de dilución (Pipeta de Thomas). ---------------------------------------->
- Cámara para el recuento celular.
- Cámara para la incubación.
- Microscopio óptico.
En la realización de este recuento se emplea la cámara de Neubauer, en ella se cuentan los eritrocitos situados en los cuatro cuadros de las esquinas y el situado en el centro, en total hay 16x5=80 cuadradito. El resultado final de este recuento se obtiene multiplicando el número de eritrocitos contados por 10.000 y por diez elevado a 6. Para este recuento se utiliza como líquido de dilución el líquido de Hayem, este se emplea para realizar una dilución de 1/200. Por último, con la dilución se llena la cámara por capilaridad.
En este recuento se emplea como líquido de dilución el líquido de Turk, para poder realizar una dilución 1/20. A excepción de lo anterior, el proceso para llevar a cabo el recuento es el mismo que en el caso del recuento eritrocitario. A la hora de hacer los cálculos si existen diferencias, en este caso el recuento se obtiene multiplicando por 50 y por diez elevado a seis las células encontradas en la cámara de Neubauer y solo se cuentan los cuatro cuadrados de las esquinas.
Este recuento se puede llevar a cabo tanto en cámara como tras un examen de frotis teñido con una tinción panóptica. El examen tras frotis es el más empleado, se denomina método Fonio y con él se obtiene una estimación indirecta de las plaquetas presentes en un frotis en relación con el número de hematíes.
RECUENTO HEMATOLÓGICO AUTOMÁTICO
Como se ha mencionado anteriormente, con el progreso obtenido en la ciencia a través de los años también han progresado los métodos de análisis de las células en suspensión y han avanzado los adelantos informático; gracias a todo ello las maquinas empleadas en el laboratorio permiten soportar grandes cantidades de trabajo cada día.
El primer recuento celular sanguíneo automatizado se realizó en 1949, gracias al trabajo que realizado Wallace Coulter para el recuento de partículas. Coulter ideo un sistema que se centraba en el recuento de partículas mediante la detección de la diferencia de potencial provocada por las células que pasaban individualmente por un orificio que separaba dos medios con carga eléctricamente diferente. (Esquema funcionamiento principio de coulter).
Tras varios años de desarrollo y varias aportaciones importantes a este campo además de la Coulter, actualmente la base de los hemogramas automáticos son 3 procedimientos: la impedancia, la espectrofotometría con luz halógena y la dispersión de la luz láser.
Este método se basa en la resistencia que ofrecen las células al paso de la corriente eléctrica cuando atraviesan un orificio de apertura que separa dos medios isotónicos con diferente potencial. Cada vez que una célula atraviesa el orificio mencionado, da lugar a un cambo de la resistencia eléctrica que es directamente proporcional a volumen de la célula que pasa. El impulso producido es recogido en un osciloscopio que, con los sistemas de filtro de interferencias, permite calcular el tamaño celular y trasladarlo a una curva de resultados. Este método es quizás el sistema más fiable para la medición de VCM.
Este sistema es capaz de realizar recuentos de las tres líneas celulares, gracias a que la maquinaria que se emplea para ello cuenta con dos aperturas de diferentes diámetros. La apertura de menor diámetro se emplea para el recuento de eritrocitos y plaquetas, mientras que la de mayor tamaño se emplea para el recuento de leucocitos.
En lo referente a la serie roja, gracias a este método se obtiene tanto el número de células que tiene el paciente, como el tamaño medio de las mismas. Además, se dispone de una curva que comprende desde la célula más pequeña hasta la más grande. Ello nos aporta la información del Ancho Distribución Eritrocitaria, indicador de anisocitosis. Este método también permite calcular la hemoglobina.
Con respecto a la serie blanca, este método permite obtener hasta 3 subpoblaciones leucocitarias diferentes (linfocitos, monocitos y polimorfonucleares), aunque da una información meramente informativa.
- Método dispersión lumínica.
Este método consiste en analizar el efecto que sobre un haz de luz monocromática de alta intensidad (láser) ejercen las células, al cruzarse una a una en su trayectoria. El lugar donde se produce el encuentro entre las células alineadas y la luz láser recibe el nombre de célula o cámara de flujo.
La dispersión lumínica se detecta mediando dos sensores, uno de ángulo grande (fotomultiplicador) y otro de ángulo pequeño (fotodetector). El fotomultiplicador detecta la dispersión lumínica lateral, su intensidad es directamente proporcional a la complejidad de dicha estructura. El fotodetector detecta la dispersión lumínica frontal, su intensidad es directamente proporcional al tamaño celular. La información de ambos es recibida por los ordenadores presentes en los equipos y estos van a expresar los datos obtenidos de tres maneras:
- Datos numéricos: Es la representación cuantitativa del análisis realizado. Permite realizar recuentos de serie roja, plaquetas y series blanca.
- Histogramas: Son representaciones gráficas.
- Citogramas o scattergramas: Son representaciones gráficas multiparamétricas. Se refieren al recuento diferencial leucocitario o a la serie roja.
Este método se basa en la aplicación de tres principios físicos relacionados con la célula: su volumen (V), determinados por la impedancia, la conductividad (C) medida por la capacidad de transmisión de ondas de alta frecuencia por el citoplasma células y la dispersión de la luz láser.
- Volumen. Se emplea para la determinación del volumen total celular. Cuando una partícula celular irrumpe el paso de la corriente eléctrica entre dos electrodos, la cantidad de corriente interrumpida indica el tamaño (volumen) de la célula.
- Scatter. Un láser emite luz de una intensidad fija que permite evaluar la superficie celular. Si la luz incide sobre una célula de superficie lisa, como un linfocito, la reflexión detectada por el sensor será muy baja; pero si la célula posee una membrana celular rugosa o con proyecciones, como los granulocitos, la luz se vera altamente dispersada hacia el sensor. Además, el número y posición de los gránulos en el interior de la célula influirá sobre la manera en que se disperse la luz.
- Conductividad. Gracias al empleo de una corriente eléctrica de alta frecuencia que atraviesa la célula, se adquiere información sobre la complejidad y características del núcleo celular y del citoplasma.
Por lo tanto, la tecnología VCS nos proporciona información de 3 tipos y con ella se puede realizar un grafico de 3 ejes que conforman un cubo, dentro de este hay un número elevado de cubitos pequeños. El sistema informático que recoge la información de cada célula que pasa la envía a cada uno de estos cubitos que conforman la imagen de la series blanca suministrado por estos equipos.
- Método de la fluorescencia.
Este método se desarrollo gracias a la capacidad de las células de emitir fluorescencia al unirse con un fluorocromo. La base de este método esta en la excitación del fluorocromo por una fuente de luz láser, que emite una luz de longitud de onda conocida y, por tanto, identificable. Cada célula emite una señal luminosa que es recogida por detectores y transformada en información tras su procesado informático. Una de las utilidades de procedimiento es la identificación celular por citometría de flujo.